Биологический факультет
Кафедра биофизики
119991, Москва, ГСП-2, Ленинские горы. Телефон (495) 939-1116, факс 939-1115.
| ! | Это архивная версия сайта кафедры биофизики от 2020 года. Актуальный сайт доступен по адресу https://www.biophys.msu.ru/. |
Кинетические модели процессов в мембране тилакоида
Система первичных процессов фотосинтеза – одна из наиболее изученных субклеточных систем. За последние полвека за изучение процессов фотосинтеза присуждено 6 Нобелевских премий. Пространственная организация фотосинтетической мембраны изучается методами рентгеноструктурного анализа, электронной и туннельной микроскопии; в настоящее время известна молекулярная структура основных фотосинтетических мультиферментных комплексов. Методами спектроскопии (флуорометрия, ЭПР и др.) установлены константы скоростей отдельных элементарных реакций. Анализ экспериментальных кривых для разных условий в эксперименте и в природе позволяет сделать выводы о том, как меняются внутренние параметры фотосинтетического аппарата при изменении светового режима при голодании, в присутствии токсичных агентов. Для понимания законов регуляции на уровне тилакоида, хлоропласта, клетки кинетические и структурные данные интегрируют в виде математических и компьютерных моделей.
Кинетические модели процессов в фотосинтетической мембране основаны на современных представлениях о механизмах переноса электрона в мультиферментных комплексах и транспорта ионов через мембрану. Они позволяют воспроизвести наблюдаемые в эксперименте на суспензиях хлоропластов и клеток водорослей, а также на листьях зеленых растений, кривые индукции флуоресценции, сигналы ЭПР, кинетику электрического потенциала.
Модель включает детальное рассмотрение переходов между состояниями мультиферментного комплекса ФС II, процессы в цитохромном комплексе и ФС I, трансмембранный транспорт протонов и других ионов, активность ATP-синтазы, роль буферных групп. Впервые в мировой литературе учитывается влияние на скорость процессов трансмембранного электрического и электрохимического потенциала, генерируемого электронными и ионными потоками. Модель описывает особенности кинетической кривой индукции флуоресценции при разных режимах освещенности во временном интервале от мкс до 10 сек и позволяет анализировать вклад отдельных процессов в наблюдаемую в эксперименте картину. Детальное кинетическое моделирование процессов в специальных экспериментальных условиях позволяет оценить параметры процессов, не подающиеся прямому экспериментальному измерению.
Результаты идентификации параметров модели в разных условиях выращивания автотрофных организмов позволяют использовать анализ индукционных кривых флуоресценции для целей экологического мониторинга и контроля за биотехнологическими процессами.
Иллюстрации:
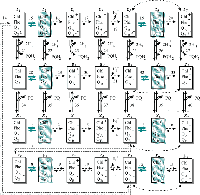 Схема каталитического цикла фотосистемы II. Каждый прямоугольник представляет собой одно из кинетических состояний ФС II, определяемое редокс состоянием входящих в него переносчиков электрона. Затененными показаны состояния, способные к испусканию квантов флуоресценции. Chl – весь хлорофилл ФС II, включая пигменты антенны и пигмент реакционного центра Р680; Phe – первичный акцептор электронов феофитин; QA и QB – первичный и вторичный хинонные акцепторы. PQ – пластохинон; PQH2 – пластохинол; HL+ – протоны, выделяемые в люмен, HS+ – протоны, поглощаемые из стромы тилакоида. Пунктирными стрелками показаны быстрые (с характерным временем менее 0.1 мс) стадии цикла, сплошными стрелками – медленные (с характерным временем не менее 1 мс) стадии, жирными стрелками – световые стадии. Цифры рядом со стрелками соответствуют номерам реакций, буквы над прямоугольниками (xi , yi , zi , gi; i=1…7) – обозначениям переменных модели. Пунктирными дугами показаны процессы безизлучательной рекомбинации Phe– с P680+ (реакции 42-46), QA– с P680+ (реакции 47-51).
Схема каталитического цикла фотосистемы II. Каждый прямоугольник представляет собой одно из кинетических состояний ФС II, определяемое редокс состоянием входящих в него переносчиков электрона. Затененными показаны состояния, способные к испусканию квантов флуоресценции. Chl – весь хлорофилл ФС II, включая пигменты антенны и пигмент реакционного центра Р680; Phe – первичный акцептор электронов феофитин; QA и QB – первичный и вторичный хинонные акцепторы. PQ – пластохинон; PQH2 – пластохинол; HL+ – протоны, выделяемые в люмен, HS+ – протоны, поглощаемые из стромы тилакоида. Пунктирными стрелками показаны быстрые (с характерным временем менее 0.1 мс) стадии цикла, сплошными стрелками – медленные (с характерным временем не менее 1 мс) стадии, жирными стрелками – световые стадии. Цифры рядом со стрелками соответствуют номерам реакций, буквы над прямоугольниками (xi , yi , zi , gi; i=1…7) – обозначениям переменных модели. Пунктирными дугами показаны процессы безизлучательной рекомбинации Phe– с P680+ (реакции 42-46), QA– с P680+ (реакции 47-51).
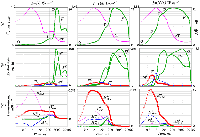 Индукционные кривые, рассчитанные с помощью модели первичных процессов фотосинтеза для трех разных интенсивностей освещения объекта: 1000, 100 и 10 (1%) Вт.м–2. Рисунки, расположенные в одном столбце, соответствуют одинаковому уровню освещенности. Результаты показаны на логарифмической шкале времени. (а) относительный выход флуоресценции (F) и значение транс-мембранного электрического потенциала (ΔΨ); (б) концентрации различных возбужденных состояний ФС II; (в) скорости процессов, генерирующих и потребляющих электрический заряд в люмене тилакоида: H+bf – поток протонов в люмен при окислении пластохинола на люменальной стороне bf комплекса; H+КВК – поток протонов в люмен от кислород-выделяющего комплекса ФС II; H+АТФ – скорость потребления протонов люмена в АТФ-синтазной реакции; K+leak – скорость утечки ионов K+ из люмена тилакоида.
Индукционные кривые, рассчитанные с помощью модели первичных процессов фотосинтеза для трех разных интенсивностей освещения объекта: 1000, 100 и 10 (1%) Вт.м–2. Рисунки, расположенные в одном столбце, соответствуют одинаковому уровню освещенности. Результаты показаны на логарифмической шкале времени. (а) относительный выход флуоресценции (F) и значение транс-мембранного электрического потенциала (ΔΨ); (б) концентрации различных возбужденных состояний ФС II; (в) скорости процессов, генерирующих и потребляющих электрический заряд в люмене тилакоида: H+bf – поток протонов в люмен при окислении пластохинола на люменальной стороне bf комплекса; H+КВК – поток протонов в люмен от кислород-выделяющего комплекса ФС II; H+АТФ – скорость потребления протонов люмена в АТФ-синтазной реакции; K+leak – скорость утечки ионов K+ из люмена тилакоида.
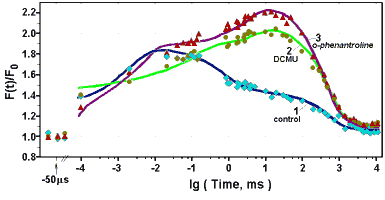
Кривые лазер-индуцированной индукции флуоресценции, полученные в экспериментах на клетках Chlorella pyrenoidosa в обычных условиях (♦) и в присутствии блокаторов электронного транспорта диурона (●) и о-фенантролина (■), и рассчитанные с помощью модели (линии).
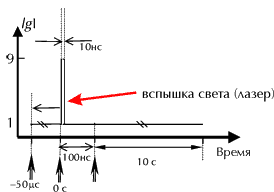
Режим освещения, использованный при регистрации флуоресцентных данных.
По теме работают: к.ф-м.н. Наталья Евгеньевна Беляева, асс. Лада Джураевна Терлова в сотрудничестве с экспрементальными группами кафедры: проф. Александр Александрович Булычев, проф. Татьяна Евгеньевна Кренделева, проф. Дмитрий Николаевич Маторин, проф. Владимир Захарович Пащенко, проф. Сергей Иосифович Погосян, д.б.н. Юрий Константинович Чемерис и др.
![[Кафедра биофизики]](/images/logo.jpg)