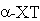 )
и ацетилхолинэстеразы (АХЭ) последовательно рассматриваются следующие этапы
взаимодействия субстрата (АВ) с активным центром гидролитических ферментов:
)
и ацетилхолинэстеразы (АХЭ) последовательно рассматриваются следующие этапы
взаимодействия субстрата (АВ) с активным центром гидролитических ферментов:
Романовский Ю.М.1, Нетребко А.В.
1Московский государственный университет им. М.В. Ломоносова, физический факультет,
Московский государственный университет им. М.В. Ломоносова, НИИ механики, 119899, Москва, Воробьёвы Горы, Россия; E-mail: romanov@lbp.ilc.msu.su
“Задача о взаимодействии простейшего субстрата с ферментом может быть
сформулирована как задача о молекуле АВ в поле нескольких лигандов” (Волькенштейн
М.В., Голованов И.Б., Соболев В.М.). На примере -химотрипсина (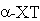
а) подход АВ к входной щели активного центра (АЦ) фермента;
б) проникновение молекулы субстрата в флюктуирующую щель АЦ;
в) встречу АВ с каталитической группой (КГ) внутри АЦ и ее комплементарное связывание;
г) перестройку КГ и атаку активным атомом (ионом) КГ разрываемой связи между А и В;
д) уход продуктов реакции А и В.
На всех этапах делаются оценки статистических характеристик диффундирующих молекул АВ и молекул продуктов А и В, колебаний атомных групп, образующих входную щель АЦ, и колебаний АВ относительно активного атома КГ (атома О (Ser)), изменений длины и потенциального барьера водородной связи между атомом О (Ser) и атомом N (His).
Делается обзор соответствующих математических моделей кластерной динамики: приводится модель молекулы АХТ, состоящая из шести относительно жестких кластеров, формирующих субглобулы и АЦ АХТ; модели проникновения молекул субстрата в АЦ АХЭ и их взаимодействия с молекулами А и В; модели переноса протона в КГ АЦ АХТ и АХЭ, который определяет разрыв связи в АВ; модели колебаний молекулы субстрата, связанной вблизи КГ, необходимых для разрыва связи. Показано, что учет взаимодействия мод колебаний в 2D и 3D моделях и осцилляций параметров потенциального рельефа в АЦ со связанным субстратом способствует увеличению скорости оборота ферментов.
Работа поддержана грантами РФФИ и Центра фундаментального естествознания
Минобразования РФ.