Молекулярные модели первичных процессов взаимодействия свободного гемоглобина с синтетическим ретинолом и его гомологами
Резван С.Г, Артюхов В.Г.
Воронежский государственный университет, биолого-почвенный факультет,
кафедра биофизики и биотехнологии, 394693, Воронеж, Университетская пл.,
1, Россия
С целью изучения первичных процессов взаимодействия белковых систем
с синтетическим ретинолом1 ( -иононом,
дегидролиналоолом (ДГЛ) и метилгептеноном (МГ) - промежуточными продуктами
синтеза витамина А1) на модельной системе "белок-реагент"
была проведена серия опытов по изучению спектральных свойств водных растворов
гемоглобина, модифицированного инклюзионными комплексами (ИК) (
-иононом,
дегидролиналоолом (ДГЛ) и метилгептеноном (МГ) - промежуточными продуктами
синтеза витамина А1) на модельной системе "белок-реагент"
была проведена серия опытов по изучению спектральных свойств водных растворов
гемоглобина, модифицированного инклюзионными комплексами (ИК) (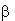 -циклодекстрин
(
-циклодекстрин
( -ЦД) - реагент. Для выявления характера структурных
изменений гемоглобина регистрировали электронные спектры поглощения его
водных растворов (СHb = 6,8·10-6 моль/л) c ИК МГ
(ДГЛ, b-ионон, ретинол) -
-ЦД) - реагент. Для выявления характера структурных
изменений гемоглобина регистрировали электронные спектры поглощения его
водных растворов (СHb = 6,8·10-6 моль/л) c ИК МГ
(ДГЛ, b-ионон, ретинол) - 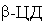 (Смод = 1·10-8
- 1·10-3 моль/л) на спектрофотометре "Specord UV VIS".
(Смод = 1·10-8
- 1·10-3 моль/л) на спектрофотометре "Specord UV VIS".
Анализ характера изменения спектральных свойств модифицированных растворов
гемоглобина позволил установить, что на оптическую активность гема оказывает
влияние преимущественно полярность карбонильной группы, а степень блокирования
хромофорных участков ароматических аминокислот определяется суммарной полярностью
и размером молекулы-реагента. Совокупность отмеченных свойств в молекуле
b-ионона (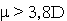 , ароматический СH-радикал с активными
центрами связывания по С5-6 и С7-8- атомам) предопределила
его наибольшую активность, инициирующую переход HbO2 в метформу,
сопряженный с денатурацией белковой глобулы.
, ароматический СH-радикал с активными
центрами связывания по С5-6 и С7-8- атомам) предопределила
его наибольшую активность, инициирующую переход HbO2 в метформу,
сопряженный с денатурацией белковой глобулы.
Динамика перехода системы Mod + HbO2 в конечный продукт с
образованием комплекса "Mod-MtHb" также определяется полярностью
и размерами реагента (соотношения их величин обратны). Анализ зависимости
скорости накопления конечного продукта от типа и концентрации модифицирующих
агентов показал, что наибольшая активность индуцированного перехода HbO2
в MtHb характерна для кетонов ( ). На основании
сравнительного анализа распределения скоростей окисления гема и сопряженного
перехода нативной формы белка в окисленную с денатурированной структурой
установлено, что:
). На основании
сравнительного анализа распределения скоростей окисления гема и сопряженного
перехода нативной формы белка в окисленную с денатурированной структурой
установлено, что:
а) по суммарной химической активности, вызывающей изменения спектральных
свойств растворов гемоглобина в условиях интоксикации (Смод
> 1·10-5 моль/л), кетоны и спирты формируют следующий убывающий
ряд:
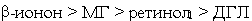 ;
;
б) по начальной скорости модификации спектров поглощения растворов гемоглобина:
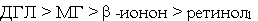 .
.
На основании полученных данных нами предложены молекулярные модели химической
модификации белка изопреновыми кетонами (I) и моно(ди)терпеновыми спиртами
(II). Условно модель I представлена рядом последовательных реакций N-присоединения
по карбонильной группе, а также по С5-6 и С7-8 атомам
СН-радикала (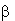 -ионон). Возможные типы химического
взаимодействия третичного монотерпенола ацетиленового ряда (ДГЛ) и ароматического
ретинола с молекулой гемоглобина (II) представлены реакциями N-замещения
по НО-группе, реакциями димеризации с гидроксилом тирозина, N-присоединения
по С5 атому карбонила ДГЛ, а также N-присоединения по С5-6,
С7-8 и С11-12 атомам дитерпенола. Предлагаемые модели
(I, II) реакций химической модификации белковой молекулы условно отражают
суммарный вклад отдельных типов изменений в процесс деструкции гемопротеида.
-ионон). Возможные типы химического
взаимодействия третичного монотерпенола ацетиленового ряда (ДГЛ) и ароматического
ретинола с молекулой гемоглобина (II) представлены реакциями N-замещения
по НО-группе, реакциями димеризации с гидроксилом тирозина, N-присоединения
по С5 атому карбонила ДГЛ, а также N-присоединения по С5-6,
С7-8 и С11-12 атомам дитерпенола. Предлагаемые модели
(I, II) реакций химической модификации белковой молекулы условно отражают
суммарный вклад отдельных типов изменений в процесс деструкции гемопротеида.
 -иононом,
дегидролиналоолом (ДГЛ) и метилгептеноном (МГ) - промежуточными продуктами
синтеза витамина А1) на модельной системе "белок-реагент"
была проведена серия опытов по изучению спектральных свойств водных растворов
гемоглобина, модифицированного инклюзионными комплексами (ИК) (
-иононом,
дегидролиналоолом (ДГЛ) и метилгептеноном (МГ) - промежуточными продуктами
синтеза витамина А1) на модельной системе "белок-реагент"
была проведена серия опытов по изучению спектральных свойств водных растворов
гемоглобина, модифицированного инклюзионными комплексами (ИК) (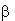 -циклодекстрин
(
-циклодекстрин
( -ЦД) - реагент. Для выявления характера структурных
изменений гемоглобина регистрировали электронные спектры поглощения его
водных растворов (СHb = 6,8·10-6 моль/л) c ИК МГ
(ДГЛ, b-ионон, ретинол) -
-ЦД) - реагент. Для выявления характера структурных
изменений гемоглобина регистрировали электронные спектры поглощения его
водных растворов (СHb = 6,8·10-6 моль/л) c ИК МГ
(ДГЛ, b-ионон, ретинол) - 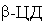 (Смод = 1·10-8
- 1·10-3 моль/л) на спектрофотометре "Specord UV VIS".
(Смод = 1·10-8
- 1·10-3 моль/л) на спектрофотометре "Specord UV VIS".
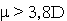 , ароматический СH-радикал с активными
центрами связывания по С5-6 и С7-8- атомам) предопределила
его наибольшую активность, инициирующую переход HbO2 в метформу,
сопряженный с денатурацией белковой глобулы.
, ароматический СH-радикал с активными
центрами связывания по С5-6 и С7-8- атомам) предопределила
его наибольшую активность, инициирующую переход HbO2 в метформу,
сопряженный с денатурацией белковой глобулы.  ). На основании
сравнительного анализа распределения скоростей окисления гема и сопряженного
перехода нативной формы белка в окисленную с денатурированной структурой
установлено, что:
). На основании
сравнительного анализа распределения скоростей окисления гема и сопряженного
перехода нативной формы белка в окисленную с денатурированной структурой
установлено, что: 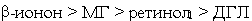 ;
;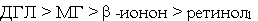 .
.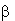 -ионон). Возможные типы химического
взаимодействия третичного монотерпенола ацетиленового ряда (ДГЛ) и ароматического
ретинола с молекулой гемоглобина (II) представлены реакциями N-замещения
по НО-группе, реакциями димеризации с гидроксилом тирозина, N-присоединения
по С5 атому карбонила ДГЛ, а также N-присоединения по С5-6,
С7-8 и С11-12 атомам дитерпенола. Предлагаемые модели
(I, II) реакций химической модификации белковой молекулы условно отражают
суммарный вклад отдельных типов изменений в процесс деструкции гемопротеида.
-ионон). Возможные типы химического
взаимодействия третичного монотерпенола ацетиленового ряда (ДГЛ) и ароматического
ретинола с молекулой гемоглобина (II) представлены реакциями N-замещения
по НО-группе, реакциями димеризации с гидроксилом тирозина, N-присоединения
по С5 атому карбонила ДГЛ, а также N-присоединения по С5-6,
С7-8 и С11-12 атомам дитерпенола. Предлагаемые модели
(I, II) реакций химической модификации белковой молекулы условно отражают
суммарный вклад отдельных типов изменений в процесс деструкции гемопротеида.