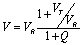 ,
, Ковалева Т.А.
Воронежский государственный ниверситет, кафедра биофизики и биотехнологии, 394693, Воронеж, Университетская пл. 1, Россия
В связи с развитием биохимической технологии исследование кинетико-термодинамических закономерностей катализа иммобилизованными ферментами, влияние носителя на локальную концентрацию компонентов ферментативного процесса, распределение субстрата между средой носителя и раствором приобретает особую значимость. В этой связи исследовали кинетико-термодинамические параметры реакции гидролиза крахмала и инулина иммобилизованными амилазами. Глюкоамилазу и инулазу иммобилизовали на ионитах Дуолит А368 PR и АВ-17-2П модифицированным глутаральдегидным методом. Содержание белка в иммобилизованных ферментах определяли модифицированным методом Лоури, каталитическую активность глюкоамилазы измеряли глюкозооксидазным методом, а инулазы-спектрофотометрическим методом при помощи резорцина. Для вычисления кинетических параметров ферментативных реакций использовали метод графов, так как зависимость каталитической активности свободных и иммобилизованных глюкоамилазы и инулазы от концентрации субстрата не соответствует уравнению Михаэлиса. Поэтому мы применяли уравнение скорости (V) ферментативной реакции
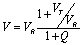
где VR и VT - скорости реакции гидролиза полисахаридов в состоянии молекулы фермента R и T соответственно; Q- конформационная функция.
Зависимость конформационной функции от концентрации субстрата выражали следующим аналитическим уравнением:
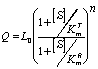
где n - число субъединиц в молекуле фермента, L0 - константа
конформационного перехода из состояние R в состояние Т, S - концентрация
субстрата, 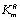
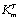
Показано, что L0 ферментативной реакции гидролиза крахмала при иммобилизации глюкоамилазы уменьшается (6,69 и 2,1 для свободного и ковалентно связанного фермента соответственно). Для расчета термодинамических параметров ферметативнных реакций использовали уравнение Аррениуса в интегральной форме, изменение энтальпии (DH) определяли по тангенсу угла наклона прямой модифицированной диаграммы Аррениуса, DS рассчитывали по основному термодинамическому уравнению. Установлено, что при иммобилизации на ионитах Еакт. увеличивается, что вполне согласуется с экспериментальными данными по изучению каталитической активности ковалентно связанных амилаз.
Иммобилизации приводит к увеличению 
